
Con el apoyo de la VID
Buscador
¿Una nueva alternativa para adelgazar?
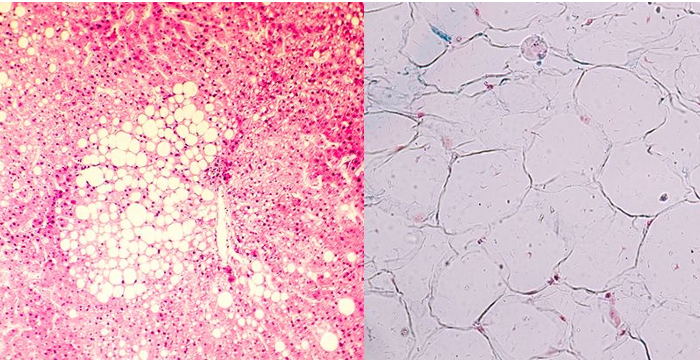
Así lo da a conocer la investigadora, explicando en primer término que las células adiposas pardas conforman un tejido que se caracteriza por su color marrón y por su papel en la producción de calor. Entre sus funciones, destaca que producen calor en respuesta al frío, absorben grandes cantidades de glucosa y ácidos grasos del torrente sanguíneo y ayudan a regular los niveles de azúcar en sangre y los lípidos. Los recién nacidos tienen una cierta cantidad de tejido adiposo pardo que desaparece muy rápidamente con el desarrollo y las personas obesas tienen menor cantidad de estas células y más de las blancas, que son las que se acumulan en la zona del vientre.
Por eso, su proyecto de investigación “Exploración de las acciones antiobesogénicas de un derivado catiónico lipofílico del ácido gálico a través del pardeamiento del tejido adiposo” tiene como objetivo que las células adipositas blancas adquieran las cualidades beneficiosas para el organismo de las pardas; es decir, “transformándolas de blancas a beige”.
Para ello, utilizará un derivado catiónico, moléculas que tienen carga positiva y afinidad por las mitocondrias, que el químico Cristián Suárez, de la Universidad del Desarrollo, sintetiza a partir del ácido gálico, un compuesto fenólico hidrosoluble que se encuentra en muchas plantas y frutas, como las uvas, el té y la corteza de roble. La idea es que, como este derivado tiene carga positiva, sea atraído para entrar en mitocondrias de las células adiposas, que son verdaderas “centrales eléctricas”, pero de carga negativa. “El efecto de este proceso es que se va a desacoplar la cadena transportadora de electrones; así es como este compuesto puede modular acciones mitocondriales que llevan a que una célula del tejido adiposo blanco, cuya función primordial es almacenar lípidos, se transforme en una nueva célula pardeada, que tiene una connotación energética activa y que, en vez de guardar la gota lipídica, lo que hace es generar el aumento del metabolismo”, detalla la doctora Catalán.
No, no es igual. El tejido adiposo se compone de tres tipos: el tejido adiposo blanco que es el almacenador, que está generalmente a nivel visceral y es el característico de la obesidad; el tejido adiposo pardo, cuya función primordial es regular la temperatura del cuerpo y que en los pacientes que tienen obesidad, o sea, un mayor engrandecimiento del tejido visceral blanco, está reducido significativamente, por lo que pierden su potencial benéfico. Y adicionalmente existe un tejido que se pardea, que en este caso es el tejido adiposo blanco que se puede transformar en beige y, por lo tanto, se localiza primordialmente donde está el tejido blanco.
¿El objetivo del estudio sería establecer las bases como para crear a futuro un medicamento, para transformar del tejido adiposo blanco en beige, de manera de aprovechar sus beneficios, y ayudar a la reducción de obesidad?
Sí, lo que nosotros buscamos con este proyecto es poder encontrar una terapia que sea costo-efectiva, porque en la actualidad ya existen, pero el problema es que son muy caras. Una de las cosas más importantes de la síntesis de moléculas pequeñas, como es esta, es que involucra muy poco gasto dentro de su generación, y que sean altamente efectivas. Lo que buscamos no solamente es este pardeamiento, sino que el proceso tenga un efecto global en la pérdida de peso, y es lo que estudiaremos en modelos in vitro e in vivo, para ver si estos resultados se traducen en reducir el grado de obesidad y en los beneficios que trascienden de esa pérdida de peso. Un ejemplo de ello es que en la obesidad existe la denominada inflamación de bajo grado, donde la secreción de citoquinas y adipoquinas se ve alterada; por tanto, el poder normalizar la función secretora del tejido adiposo blanco se convierte en un aspecto a considerar dentro de un tratamiento farmacológico para la obesidad.
La magnitud del efecto de pardeamiento no debería ser tan grande, sino en una cantidad suficiente para normalizar la secreción de sustancias desde el tejido adiposo. De hecho, el efecto que debería tener como antiobesogénico adicionalmente es poder, por ejemplo, permitir el aumento de la lipólisis y de la beta-oxidación en la célula adiposa del tejido blanco, que está enferma. Eso lleva a que se reduzca el contenido del lípido y a que se pierda grasa. Nosotros hemos hecho estudios preliminares acerca de estos hallazgos, y efectivamente en un ensayo piloto observamos que ratones alimentados con dieta alta en grasa eran capaces de reducir el incremento de peso, pese a lo que comían, sin efectos adversos evidenciables. De hecho, otro de los hallazgos importantes es que se reduce la esteatosis hepática asociada a la obesidad. O sea, si nosotros le sumáramos a ese modelo una dieta calórica restringida el impacto de la intervención podría ser aún mayor; incluso a niveles de lo que podemos observar en la actualidad con nuevas drogas como el semaglutide.
“Entonces en una etapa futura, la idea sería poder entregar el fármaco en forma oral para evidenciar aspectos de su farmacocinética; su estructura es capaz de ser metabolizada, por tanto, debería tener una farmacocinética predecible. En el actual estudio no tenemos contemplado hacer eso, pero sí analizar la administración oral”, finaliza.
Cecilia Valenzuela León

Con el apoyo de la VID

Un homenaje de la Facultad de Medicina de la U. de Chile al personal de salud

Reconocimiento destaca trayectoria científica y formativa
.jpg.jpg)
Reconocimiento institucional